“1971 年,Judah Folkman 教授提出 “肿瘤生长和转移依赖于血管新生” 理论,认为新血管的形成对于肿瘤生长和转移至关重要。”
肿瘤细胞需要新生血管来提供营养和氧气,以维持其持续生长和扩散。研究肿瘤细胞的血管生成能力和血管侵袭能力对于了解肿瘤生物学机制,以及发展抗肿瘤治疗策略具有重要意义。成血管实验可以模拟肿瘤微环境,评估肿瘤细胞及其周围细胞对血管生成的影响。
成血管实验怎样设计?
跪求具体实验 Protocol?
一文走进热门实验技术,为发表高分文献提供新思路,“胶”你做实验!
TIPS:
l 在成血管前需要饥饿培养细胞,以增加细胞对生长因子和刺激因子的敏感性,促进血管生成。常用于成血管研究的细胞类型有 HUVEC、HMVEC、HMEC-1 等
l 在成血管实验中通常有对照组与添加促进或抑制血管生成的药物进行对比,以研究该药物对肿瘤细胞成血管的影响。
l 一般成血管实验使用的基质胶浓度建议至少 10mg/mL,更高浓度的基质胶效果会缩短血管开始形成的时间,并且血管形成时间更长,易于确定观察时间窗口。
前排插播
前排插播
NEST 的 GelNestTM基质胶取自小鼠肿瘤组织,可增强细胞粘附、分化和增殖。它模拟生理环境,是组织工程和细胞培养研究的理想选择,尤其适用于类器官和干细胞培养。它还有助于癌症研究,如侵袭、血管生成和体内肿瘤形成实验。
成血管专用款基质胶浓度在 12-14mg/mL,相比标准款与低因子款更适合用于体外成血管实验。
材料与方法
材料与方法
Part.01 GelNestTM成血管专用基质胶包被
1. 在 96 孔板的底部均匀铺上 50µL GelNest™基质胶原液(推荐 211492,浓度>12mg/mL),添加时避免气泡产生。24 孔每孔约加 280μL,其他孔板按培养面积大小增减。(为防止基质胶粘附在枪头内壁, 在吸取基质胶前可用枪头吹吸一次 FBS,对枪头内壁进行 FBS 润洗。)
2. 将培养板置于 37℃培养箱 30 至 60 分钟。若有液体剩余,可用移液枪轻轻吸出。
3. 包被好的培养板请尽快使用。
Part.02 HUVEC细胞培养与成血管
1. 将 HUVEC 细胞培养至 70-80%的汇合度,原代细胞代数应该在 5 代以内。
2. 将完全培养基替换成饥饿细胞用培养基:含 0.2% FBS(减血清)、2mM L-谷氨酰胺、1mM 丙酮酸钠、100U/mL 青霉素和 100µg/mL 链霉素的 DMEM 培养基,饥饿培养 24 小时。
3. 胰酶消化 HUVEC 细胞并进行细胞计数。
4. 将 5x104个 HUVEC 细胞加入含基质胶的 96 孔板的单孔中,每孔体积控制在 200µL。将 96 孔板放入培养箱中进行培养。
5. 血管样网络结构预计将在 3 至 12 小时内形成。首次实验请每隔一小时观察一次,以防血管结构继续分化,错过观察窗口。
Part.03 染色与观察
1. 血管样网络结构可以直接用相差显微镜观察,也可以用以下步骤进行荧光染色。
2. 小心去除培养基,避免破坏血管结构。加入200μL HBSS缓冲液润洗两次,并除去。
3. 加入1/1000浓度的Calcein AM(绿色)培养基进行染色。
4. 使用荧光显微镜对细胞进行成像,并记录分析血管网络的形态和特征。
实验结果分析
实验结果分析
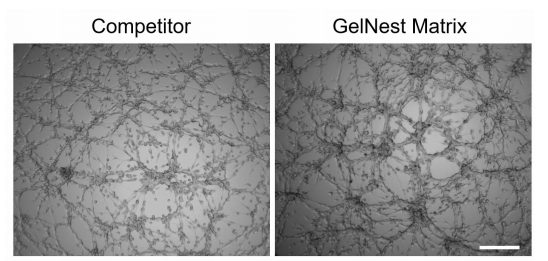
图 1.HUVEC 细胞分别在竞品和本公司(GelNest Matrix)基质胶上培养 9 个小时后形成血管网络的结果。标尺为 300µm。
可观察到在 GelNestTM 基质胶中血管样网络结构形成良好。
常见问题与解答
常见问题与解答
1. 应该采用何种培养基稀释基质胶?
建议使用不加双抗、不加胎牛血清的高糖DMEM培养基稀释基质胶。
2. 如何使铺胶更均匀?
枪头要垂直于内孔的正上方,防止有基质胶流经孔壁残留。
若是孔的底部没有铺满基质胶,可以晃动一下96孔板,使底部铺胶均匀。
若还是没有均匀铺满底部,可用枪头稍微搅动一下。
3. HUVEC必须用专用培养基吗?能不能用普通培养基?
(1) 若使用普通培养基需要添加生长因子,常见的有ECGF/ECGF,ECGF。
(2) 普通培养基+生长因子的方式价格较贵,建议使用专用ECM内皮专用培养基。
4. HUVEC细胞系换液第二天为何出现空泡化?如何解决空泡化问题?
可能原因:
(1) 培养液的pH值与细胞正常所需pH值差别太大,细胞代谢异常导致空泡化;
(2) 在细胞培养过程中由于血清浓度不够、药物作用、外界刺激等情况,导致细胞代谢出现问题,内质网应激导致出现细胞空泡化的情况。
解决方法:
(1)测定完全培养基的pH,看其酸碱性是否适宜。多数细胞适宜的pH范围为7.2-7.4。
(2)若培养基或血清是已开封且存放了很久,建议使用新鲜的完全培养基给细胞换液;若都是新开封的,建议使用新批次的基础培养基或血清来配制培养液,给细胞换液并进行观察。
5. HUVEC培养过程中出现聚团如何处理?
聚团可能是因为培养板亲水性差或者血清中的促贴壁因子不足。
解决方法:
(1) 培养瓶使用前一天使用明胶包被。
包被方法:以T25瓶为例,取用5mL明胶放入T25瓶中,37℃放置30分钟以上,将多余的明胶吸出。
(2) 提高培养液中基质胶浓度。
(3) 使用ECM内皮专用培养基进行配置。
6. 如何判断加入的基质胶体积是否合适?
在孔板下方放置一张格子纸(如图),垂直透过每个孔观察:
(1) 如果观察到的格子比实际尺寸小,基质胶加入的体积过少;
(2) 如果观察到的格子比实际尺寸大,基质胶加入的体积过多;
(3) 如果观察到的格子与实际尺寸一致,基质胶加入的体积适合。

7. 如何解决成管实验中细胞不能形成连续的网格的问题?
建议使用3-5代状态较好且融合度70%-80%的HUVEC细胞进行成管试验,此时的细胞成管能力较强。
在显微镜下边观察边使用胰酶消化细胞,当细胞变圆时及时终止消化过程。消化过度会影响成管效果。
尽可能保证细胞数量约为3万个/孔,细胞数量过少会使细胞无法形成连续的网络。
选择低生长因子基质胶进行成管实验时,可考虑在培养基中添加生长因子,刺激细胞形成网络状。
8. 细胞铺板数量如何确定?
由于计数方式的差异可能导致细胞数量的差异,可进行预实验测试合适的细胞数铺板,适宜的细胞数量如下图:
9. 成管实验需要几个小时?小管形成后为何会塌缩?
成管时间与细胞状态密切相关。细胞状态好时,2-3小时开始成管,细胞状态较差时,可能18-24h成管。建议第一次实验时,每隔一个小时观察一次。
成管时间取决于培养基中血管生成因子的浓度。肿瘤条件培养基中血管生成因子较丰富,容易成管,而基础培养基所需要的成管时间较久。
如果使用原代内皮细胞而非永生化细胞,开始成管的时间会延迟数个小时。
小管形成后有塌缩可能是培养时间过久,内皮细胞发生凋亡。
10. 血管形成实验中使用的凝胶是否需要含酚红?
对于使用相差显微镜,酚红不会干扰图片,并且由于其颜色,处理更容易。
然而,当使用荧光显微镜时,酚红可能会干扰探头的波长。在这种情况下,最好使用无酚红凝胶。