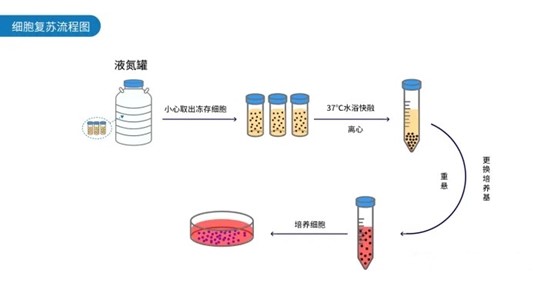
细胞复苏流程
1.从液氮罐中取出冻存细胞,放入37℃水浴锅中融化,轻柔离心后收集细胞沉淀;
2.缓慢用移液枪吸去上清,加入适量浓度和体积的完全培养基,重悬细胞沉淀,转移至细胞培养皿或细胞培养瓶;
3.根据细胞培养皿或者培养瓶的体积,补足完全培养基,放入二氧化碳培养箱中培养观察。
操作中的注意事项&小妙招
① 小心取出冻存管
许多小型液氮罐的设计是将细胞冻存在带盖的提篮中,提篮会浸没在液氮中。由于提篮中没有孔格的划分,细胞冻存管无法摆放整齐。取用细胞时候,实验人员经常需要逐一查看,寻找计划复苏的细胞,此过程耗时过久,可能会导致其他冻存管内的细胞受损。
一般大型液氮罐会配置成列的冻存架和细胞存储盒,取出冻存架和放回都需要平稳小心处理,避免带出大量液氮。罐内液氮较多时,可适当在罐口附近停留,等大部分液氮回流后再拎出。

② 快速融化待复苏细胞
当找到准备复苏的冻存管后,不要着急放入水浴锅,先检查封口膜是否完整(关于冻存细胞时,是否用封口膜的问题,有经验的呢,都会发现加不加都一样的),如果贴了医用胶布,胶布是否有破损?因为一旦冻存管中有液氮流入,直接放入水浴锅中,管内压力骤升,可能导致冻存管炸裂,危及实验人员。推荐使用内旋的冻存管,不宜爆炸。如果只有外旋的冻存管,取出后应尽快倒置/水平放置数十秒,使得液氮流出。

复苏细胞的核心技术,简而言之就是快融。从液氮罐中取出的细胞,需及时放入37℃水浴锅,进行快速融化,期间需不停地轻柔摇晃冻存管。最好在两分钟内完全融化细胞。出于卫生考虑,有些细胞房没有水浴锅,所以很多复苏操作,需要在不同实验室进行。如果两个实验室距离较远,且实验室室温较高,可提前准备一只干净的烧杯,装入37℃的水作中间缓冲。
注意
? 复苏时不要让水浴锅中的水,流入冻存管中造成污染。
? 复苏过程中要格外注重无菌操作,经水浴锅融化后,需对冻存管消毒。最好同时更换手套和口罩,全程避免移液器接触管口及管壁。小妙招:将冻存管放入无菌一次性PE手套中,再放入水中融化,避免污染也方便操作。
③ 轻柔收集细胞
收集细胞前,要将所用培养基提前预热并摆放整齐,避免现用现配耽误复苏进程,及时让刚复苏的细胞接触正常的生长环境。若冻存液中存在DMSO,请根据所用细胞对其敏感的程度,判断要不要离心弃除。离心目的,一个是去除DMSO,一个是去除死细胞。
刚复苏的细胞状态比较脆弱,应避免多次吹打和离心。比如原代细胞在复苏融化后,尽量不要进行离心操作,直接补足培养基,使细胞分散均匀,等3-6小时,细胞贴壁后,进行换液处理。此方式也适用于其他冻存状态一般的细胞。


④ 培养前,计数&活力检测
复苏过程中,细胞计数必不可少。原则上,冻存前和复苏后,都需要对细胞进行计数和活率分析,判断冻存的效果和细胞复苏后的状态。
2018年9月,美国药典(USP-NF)出台了关于细胞冻存相关政策并明确指出,台盼蓝不能很好地识别刚复苏的细胞(细胞的种类和台盼蓝的浓度不同,对染色结果都有较大的影响),建议使用两种以上的方法进行细胞计数,如结合荧光染色计数法。
⑤ 支原体或细菌的污染。分离培养物,检测支原体。清洁支架或培养箱。如发现支原体污染,丢弃培养物。建议使用的培养基提前用一次性真空过滤器过滤一下,能有效除去支原体、细菌等,0.1μm的过滤器可以去除支原体,0.22微米去除细菌。

⑥ 复苏的细胞本身状态不好,已经老化,失去贴附性,建议启用新的保种细胞。如果细胞比较珍贵或没有备份细胞,可尝试将不贴壁细胞收集离心,再用 PBS 将沉淀清洗一遍,离心后的沉淀加入胰酶重新消化接种,同时提高血清浓度到
15%~20%。
复苏后是否成功,根据接种后细胞的形态和贴壁率而定,倘若第二天有95%以上的细胞贴壁,且形态良好,则说明复苏成功。复苏接种的时候,采用较高的接种密度,使细胞的整体密度高一些,有利于细胞的生长。