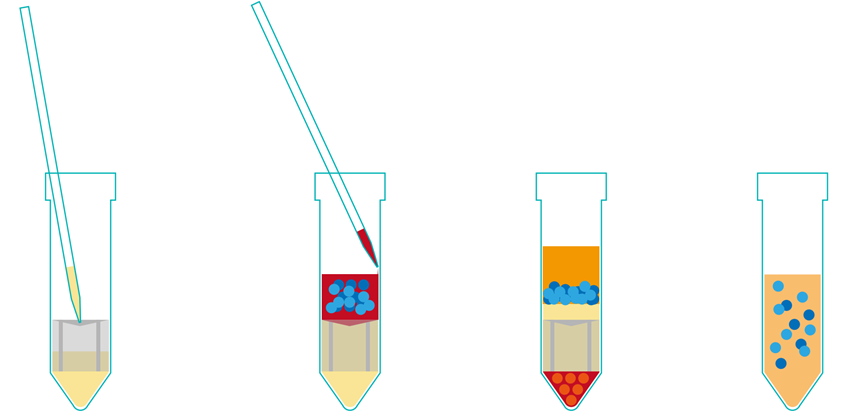
加入细胞分离液 加入样本 离心后分层 收集富集细胞、重复洗涤
1) 将抗凝样本(血或骨髓,如果需要可以用生理盐水稀释)延管壁缓慢倒入或用移液管延管壁缓慢加入到分离管中:如果用15ml的分离管建议使用4-9ml样本;如果用50ml的分离管建议使用13-30ml样本。
2) 室温下离心,离心力为1200 x g需要10分钟,关闭离心机。对于放置24h以上的样品,建议离心时间加长。
3) 离心后液体分离情况(从上到下)为:a血浆 ;b富集的细胞部分(中间相包含淋巴细胞/PBMCs细胞);c分离液;d嵌套;e沉淀(红细胞和粒细胞)。采集或丢弃富集细胞所在层以上5到10mm的血浆层有助于防止富集细胞被血小板再次污染。
4) 收获富集细胞(淋巴细胞/PBMCs细胞),将分离管中上清倒入另一干净离心管中,分离管中的嵌套能有效避免富集细胞被红细胞和粒细胞再次污染。建议不要将分离管倒置2s以上。
5) 用磷酸盐缓冲液(PBS)洗涤富集细胞(淋巴细胞/PBMCs细胞),然后在250 x g离心力下离心10分钟。
6) 按步骤5重复洗涤2次,最后用5ml PBS缓冲液重新悬浮细胞。
注意事项/ Cautions
1) 本产品应由经过专业培训的人员操作,并遵守良好的实验室规范。
2) 请勿重复使用分离管。
3) 由于各品牌离心机的性能不同,地区温度环境差异,可能影响分离效果,用户可以调节离心转速和离心的时间,摸索最佳的分离条件(具体分离条件由各实验室自定)。
4) 可用于人类外周血、骨髓和脐带血样本。它不适用于白细胞分离样本、血沉棕黄层样本或超过48小时的样本。
5) 离心后,细胞可能聚集在富集层以上的分离管的管壁上。这种聚合是正常的,受样本质量、样本放置时间和抗凝剂类型的影响。此聚合与分离管的使用无关。细胞可以通过使用移液管尖端刮管壁的一侧来清除。
6) 处理任何生物来源的标本,使用采血针、采血管系列、相关仪器等一定要注意按严格的操作规程使用。请把标本当成可能感染 HIV、HBV、HCV等传染病的危险物质处理。为避免操作时感染的危险,请使用一次性手套。